당신은 주제를 찾고 있습니까 “이온 반 경비 – 20150326 재료과학1“? 다음 카테고리의 웹사이트 th.taphoamini.com 에서 귀하의 모든 질문에 답변해 드립니다: th.taphoamini.com/wiki. 바로 아래에서 답을 찾을 수 있습니다. 작성자 OCW-HYU 이(가) 작성한 기사에는 조회수 87회 및 좋아요 1개 개의 좋아요가 있습니다.
Table of Contents
이온 반 경비 주제에 대한 동영상 보기
여기에서 이 주제에 대한 비디오를 시청하십시오. 주의 깊게 살펴보고 읽고 있는 내용에 대한 피드백을 제공하세요!
d여기에서 20150326 재료과학1 – 이온 반 경비 주제에 대한 세부정보를 참조하세요
이온 반 경비 주제에 대한 자세한 내용은 여기를 참조하세요.
The Crystal Structure of Materials
그림 2-9 배위수가 4인 경우 양이온과 음이온의. 반경 비에 따른 이온의 기하학적인 배열. The critical radius ratio is. If the radius ratio is less than this, ion A …
Source: contents.kocw.or.kr
Date Published: 7/22/2021
View: 3909
원자의 충전_폴링의 법칙
위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 … 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경 …
Source: depletionregion.tistory.com
Date Published: 3/22/2021
View: 8355
4-2. 이온 반경과 배위수 – KorEArtH NET
원자의 전자구조 – 주기율표 4-2. 이온 반경과 배위수 4-3. 화학 결합의 종류와 그에 따른 물리적 성질 4-4. 전기음성도와 이온결합성 4-5. 정출 순서와 풍화에 대…
Source: www.korearth.net
Date Published: 10/4/2021
View: 8388
4 th rule : 배위다면체의 연결 (2) 다른 양이온을 가진 결정에서는 …
원자 (이온) 반경은 원자핵의 크기와 전자의 수에 의존한다. … 음이온 반경의 합으로 주어지며 양이온의 배위수는 양이온과 음이온의 이온 반경비에 의해 결정된다.
Source: newcms.kmu.ac.kr
Date Published: 7/30/2022
View: 4781
이온반경비 – 레포트샵
이온의 크기가 음이온과 같거나, 보다 클 대에는 12배위가 된다. 그러나 다른 요인으로 이 범위를 벗어나는 일이 발생하기도 하나, 일반적으로 이온반경비로부터 예상 …
Source: www.reportshop.co.kr
Date Published: 6/23/2021
View: 5592
Chapter 3 The Structures of Simple Solids
특정한 배열이 선호되는 원인-이온반경 … Lattice: 결정에서 원자, 이온, 분자의 배열을 점의 배열로 나타냄. Lattice points는 asymmetric unit … 반경비: 0.414.
Source: chemlab.pusan.ac.kr
Date Published: 7/2/2021
View: 8434
이온 반지름 비를 통한 결정 구조 예측 – STA CHEMI STORY
이온 반지름 비를 통한 결정 구조 예측 [문제] LiBr 결정에서 이온들은 각각 면심입방 단위세포로 배열되어 있다. Li와 Br의 비율이 1 : 1인 어떤 …
Source: stachemi.tistory.com
Date Published: 2/22/2021
View: 307
주제와 관련된 이미지 이온 반 경비
주제와 관련된 더 많은 사진을 참조하십시오 20150326 재료과학1. 댓글에서 더 많은 관련 이미지를 보거나 필요한 경우 더 많은 관련 기사를 볼 수 있습니다.
주제에 대한 기사 평가 이온 반 경비
- Author: OCW-HYU
- Views: 조회수 87회
- Likes: 좋아요 1개
- Date Published: 2016. 8. 1.
- Video Url link: https://www.youtube.com/watch?v=8klBh_5GYb0
원자의 충전_폴링의 법칙
728×90
반응형
정의상 가정 원자 사이 화학결합 내용상 가정 공식 단위 응용 격자(lattice)
↑파란 박스의 글자를 클릭하시면 가정과 응용으로 넘어 가실 수 있습니다!!
원자의 충전은 말 그대로 원자 사이에 화학결합이 작용하여 쌓이는 모양입니다.
따라서 원자 사이 화학결합에 영향을 많이 받고 특히 결합이 방향성인지 비항향성인지에 따라 달라집니다.
원자 사이 화학결합에서 볼때 방향성 결합은 원자와 원자의 결합만 본다면 공유결합이 있었고 이는 결합각을 만족하면서 충전하고, 이렇게 결합되다보면 결합각이 정해집니다. 즉 결합다면체가 연결되면서 원자배열을 합니다.
반면 비방향성 결합에는 이온결합과 금속결합이 있고 이들은 구면 대칭에다가 결합각에 대한 제한이 없습니다. 크기가 다른경우에는 최대 충전을 위해 기하학적 조건에 따라 충전됩니다. 따라서 원자의 상대적인 크기에 따라 결정이 되고 원자 중심을 연결해서 만드는 배위다면체를 형성합니다.
그럼 좀더 세부적으로
방향성 결합을 먼저 보겠습니다.
원자에 대한 결합수와 결합각이 정해져 결합방향은 전자의 양자상태에 따라 결정되는데,
메탄 CH4나 다이아몬드 같은 걍우 혼성궤도를 가지게 되는데 이는 정사면체를 꼭지점으로 향하는 같은 강도의 4개의 결합으로 위 그림의 (a)와 같이 결합합니다. 이때 탄소와 같은 4족 원소인 Si, Ge, Sn 같은 원소도 혼성화로 4개의 동등한 결합을 만들고 정사면체의 꼭지점을 차지합니다.
다이아몬드는그림(a)와 같은 3차원 배열이 쭉 진행하여 그림(b)와 같은 구조를 만듦니다. 이때 탄소의 4개의 결합에 다른 원자가 붙으면 고분자나 생체 분자등을 만듦니다.
비방향성 결합의 경우 2가지로 나눌 수 있습니다. 같은 크기의 비방향성 결합과 다른 크기의 비방향성 결합.
같은 크기의 비방향성 결합은 금속결합에서 주로 나타나며, 다른크기의 비방향성 결합은 이온결합에서 주로 나타납니다.
둘다 공통적으로 단위체적당 결합 에너지를 최소ㅗ 하는 방법으로 이루어지며, 결합하나의 에너지는 음의 값을 가지므로 결합수를 증가시킬 수 록 전체 에너지는 더 큰 음의 값을 지니게 됩니다. 즉 결합에너지를 최소화 하는 방법은 단위 체적당 원자수가 최대로 충전한다는 것이고,
이 조밀 충전 방법에는 2가지가 있습니다.
위 그림 (a)는 육방 조밀 충전(hexagonal close-packing, HCP)이라 부르며 층별로 연속적인 적층이 이루어 집니다. 이차원 면으로 이루어진 1층을 A, 2층을 B라 할때 ABABABAB….로 저층이 됩니다.
그림(b)의 경우에는 입방 조밀 충전(cubic close-packing, CCP)라 부르고 면심입방(face-centered cubic, FCC)라고도 부릅니다. 이는 한 면 A가 중심인 구로 된 층에 B가 중심인 구의 층을 만들고 그 위에 다시 C가 구의 중심인 츠을 쌓습니다 ABCABCABCABC…..
이때 육방 조밀과 입방 조밀 충전은 최인점 원자가 12개이고 적층 순서가 다르다는 특징이 있습니다.
그림(c)는 체심입방구조(body-centered cubic, BCC)로 조밀충전구조는 아니지만 이것도 단위 부피에 많은 원자를 포함하는 구조중 하나입니다. 이것은 최인접 원자수가 8개입니다.
그럼 이러한 조밀충전을 해야한다는 관점에서
비방향성의 크기가 같은 원자간의 결합을 보겠습니다.
금속의 경우 모두 같은 크기의 비방향성 원자들로 결합이 됩니다. 금속은 사실 불활성 원소와 같이 꽉 채워진 전자배치와 전자구름을 가지는 데 이로인해 금속원자를 강구(hard sphere)로 간주하겠습니다. 그러면 위에서 보앗듯 육방조밀충전으로 쌓인다고 할때 아래의 그림과 같이 됩니다.
그림 (a)에서 2차원 평면에 그림(b)와 같이 사이사이에 충전되어서 한 구에는 윗면 3개, 아랫면 3개가 채워져 6개가 채워집니다. 따라서 같은 평면에 인접하고 있는 원자까지 계산하면 최인접 원자가 12개로 12개 조밀충전으로 볼 수 있습니다.
이와 같이 단위체적당 결합에너지를 최소로 하기위해 금속의 거의 대부분은 상온에서 면심입방이나 육방 조밀 충전을 가집니다.
그외 나머지는 위에서 본 체심입방구조(BCC)입니다. 예를들어 알칼리금속(Li, Na, K등)과 전이금속(Fe, Cr, W)가 체심입방구조를 가지는데 Li, Na의 경우에는 상온 상압에서는 체심 입방이고, 낮은 온도에서는 조밀충전구조가 됩니다.
반만 채워진 d궤도를 가진 전이금속의 경우 공유결합 성질이 있어 약간의 방향성 때문에 채움률이 조금 낮은 체심 입방을 가집니다. 이들은 당연히 강한 결합력을 녹는 점이 높고 변형이 어렵습니다.
참고로 이 원자가 부피안에 얼마나 충진되었는지를 나타내는게 원자 충진률(Atomic Packing Factor, APF)이고 단위 격자내의 원자의 부피/ 단위격자의 부피를 의미 합니다. 즉 APF가 낮다면 밀도가 낮은 것이고 융용점이 낮은것을 의미합니다.
BCC를 생각해본다면, 단위격자 안에 총 원자가 2개 있고( ) 가장 작은 원자 반경의 가능성을 본다면 대각선으로 으로 (a는 격자 상수)를 계산한다면 68%가 나옵니다. FCC도 동일한 방법으로 74%가 도출됩니다.
그럼 다음으로
다른크기의 비방향성 결합 원자들의 충전을 보겠습니다.
보통 이런것은 이온결합에서 주로 나타나는데 대게 양성인 원자에서 전기적으로 음성인 원자로 전자가 이동하여 음이온보다 양이온이 큰 경향이 있습니다. 어찌됬건 양이온과 음이온 크기가 다른데, 이들을 크기가 다른 구로 간주하고 보겠습니다.
이때 중요한것이 배위수(Coordination number, CN)인데 이는 한 원자 주위의 인접 원자수입니다. 이 배위수가 최대로 커야 합니다.
위 그림에서 보듯 그림 (a)는 양성자의 크기가 적어 조금한 vibration 같은 에너지가 작용해도 여기 붙었다 적이 붙었다 해서 불안정합니다. 배위수도 작습니다. 반면 그림(b)와 (c)같은 경우 안정합니다. 이는 밖에 이온끼리 서로 접하면서 중심에 있는 이온과 접할때의 이온변경비(critical radius ratio)가 임계반경비 < 반경비 의 관계를 만족해야 안정합니다. 다시말해 밖의 이온들끼리 접하고 접한 이온들의 틈에 다른 이온이 접할때의 반경비 보다 두 이온의 반경비가 크면 안정하다는 것입니다. 위 그림에서 그림(a)의 배위수가 4이면 임계반경비는 이온A의 반지름을 ,이온B의 반지름을 라 하면 는 나올수 있는 가장 작은 경우로 하고 는 접하는 이온과더한것의 관계를 이용해서 입니다. 그림 (b)의 경우에는 똑같은 원리로 모든 경우에 대해서 다 계산한 것이 위 왼쪽 그림의 표와 같습니다. 이는 배위수 기준으로 나누어놓았고 결정에서 가능한 배위수가 1, 2, 3, 4, 6, 8, 12이기 때문에 다음 배위수 밖에 없습니다. 임계반경비 보다 작으면 불안정, 이상이면 안정합니다. 그러나 반경비가 계속 커지면 어느순간 A가 커지면 B의 입장에서 안정한 반경비도 고려해야합니다. 즉 위그림 (a), (b), (c)까지 이온A가 쭉쭉 커져도 안정했지만, 너무커져 그림(d)의 상황으로 가면 이온B가 불안정 해집니다. 따라서 둘다 만족시키는 범위를 가져야합니다. 그 범위를 각각 구해보면 다음과 같고 이들의 교집합을 표현한것이 아래 그림(a)와 같습니다. 예를 들어 황화아연( )에서 Zn은 0.072nm, S는 0.184nm이므로 이온반경비는 0.072/0.184=0.391인데 이는 왼쪽표에서 배위수의 비가 1:1, 2:2, 3:3, 4:4까지 만족합니다. 이때 이온주위의 배위수는 최대로 되려는 경향이 있으므로 최대 배위수는 양이온과 음이온의 배위수 4:4가 됩니다. 즉 Zn과 S는 배위수를 4로 하면서 계속 충전을 하고 이는 아래 그림 (a)와 같이 되며 이를 스팔러라이트 구조라 합니다.(=징크블랜드 구조) 참고로 다이아몬드구조와 비슷해보이지만, 다이아몬드 구조는 동종원소 스팔러라이트구조는 이종원소라는 차이가 있습니다. 그림 (b)는 염화나트름(NaCl)인데 이것도 위와 같은 방법으로 알 수 있습니다. 즉 Na양이온의 반경이 0.095nm이고 Cl음이온의 반경이 0.18nm이므로 이온반경비는 0.527이고 이는 6:6, 4:4, 3:3, 2:2, 1:1이며 최대 배위수는 6:6이므로 두 이온이 배위수를 6개로 하면서 충전하여 이는 염화나트륨 구조가 됩니다. 그림(c)는 염화세슘(CsCl)으로 위와 같이 계산하면 최대 배위수가 8:8이 되며 이러한 배위수를 유지하며 충전됨을 알 수 있습니다. 이때 이 모양이 BCC와 비슷해보이지만 이는 이종원소이므로 Simple cubic이라 보아야합니다.(BCC는 동종원소) 참고로 이온반경이 같은 같은 크기의 양이온으로 구성된 금속의 경우 반경비가 1로 두 이온의 배위수가 12이므로 적층 순서의 종류에 따라 면심 입방(FCC)이나 육방 조밀 충전(HCP)가 됩니다. 이제 두 이온의 비율이 같지 않을때를 보겠습니다. 먼저 아래 그림 (a)와 같이 화합물 AB2인 B원자의 수가 A원자의 2배인 경우를 보겠습니다. 이때는 2:1, 4:2, 8:4, 12:6으로 나뉩니다. 만약 A2B3의 경우에는 배위수의 비가 3:2, 6:4, 12:8로 나옵니다. 그림(b)를 참조하시면 좋습니다. 예를 들어 SiO2와 같은 경우에서도 Si의 이온반경이 0.041nm이고 산소음이온 반경이 0.135nm로 이온반경비가 0.304이어 제일 안정된 배위수는 양이온과 음이온의 배위수 4:2이며 Si이온에 대한 배위수는 4, 산소에대한 배위수는 2로 하며 계속 충전되어 아래 그림 (a)와 같은 형태를 만듦니다. 이는 특별히 트리스토발라이트(Cristobalite, SiO2)라 부릅니다. 그림(b)와 같은 경우 Al2O3인데 Al의 이온반경 0.052nm이고 산소음이온반경이 0.135nm이므로 이온반경이 0.3085nm이기 때문에 배위수는 3:2가 되고, Al이 6개의 산소로 둘러 쌓여있고 4개의 Al이온이 1개의 산소이온으로 둘러싸여있는 코런덤(Corundum)구조가 만들어집니다. 이때 실제 이온의 반경비에서 구한 배위수가 차이나는 경우 때문에 실제 배위수와 반경비에서 구한 배위수가 차이가나는 경우가 있습니다. 이와같이 6:3의 경우 TiO2가 있는데 Ti의 배위수가 6개씩, O의 배위수가 3개씩 하여 아래 그림과 같은 결정구조를 가집니다. 지금까지 한 이온들의 충전에 예외적인 것들이 있는데 이 예외들을 법칙으로 만들어 논것이 있습니다. 이것이 폴링의 법칙이고 제 5법칙 까지 있습니다. 제 1법칙은 지금까지 설명한 기본적인 법칙을 요약해 둔것입니다. 즉 폴링의 제 1법칙은 음이온으로 된 배위 다면체가 각 양이온 주위에 만들어 지며 이온의 배위는 이온 반경비에 의해 결정된다는 것입니다. 제 2법칙은 전기 음성도 법칙입니다. 즉 복잡한 화합물에서 전기 음성도를 맞추며 결합한다는 법칙으로 s가 음이온과 양이온 사이의 정전기적 결합강도라 하고, 가 양이온의 전하, z가 양이온 주위의 배위수라 할 때 를 만족하고 음이온 주위에 인접하고 있는 모든 양이온 결합 강도의 합의 반대 부호가 음이온 전하를 만족해야 한다는 것입니다. 예를들어 그림 (a)와 같이 BaTiO3에서 (perovskite 구조라 합니다.) Ba의 배위수는 12이고 Ti의 배위수는 6으로 이고 O주위에 Ba가 4개 Ti가 2개로 O의 결합강도는 입니다. 그림 (b)는 그 관계를 더 간단하게 나타낸 것입니다. 플링의 3법칙은 배위 다면체의 연결에서 두 음이온 다면체가 변이나 면을 공유하면 두 양이온의 반발력이 중가하여 계의 퍼텐셜에너지가 증가하므로 두 다면체가 꼭지점(corner), 변(edge), 면(face)의 우선순위로 서로 공유하면서 충전된다는 것입니다. 이때 꼭지점이라는 것은 결정구조에서 외각에 있는 원자하나를 의미합니다. 플링의 4법칙은 배위수가 작을 수록 양이온의 전하가 클수록, 꼭지점을 공유하려는 경향이 커진다는 이온결합의 충전을 설명하는 모든 방식입니다. 예를 들어 SiO2에서 비교적 큰 전하인 Si4+의 강한 상호 반발력으로 꼭지점을 공유하며 연결합니다. 폴링의 5법칙인 한 구조에서 구성 원소의 종류의 수를 가능한 적게 하려한다는 것입니다 많은 구성 원소 종류는 여러 크깅의 이온과 음이온 다면체를 한 구조에서 효율척으로 충전하기 어렵기 때문입니다. 그러면 이를 이용해 지각의 95%나 이루는 엄청나게 중요한 규산염(Silicate) SiO2의 구조를 보겠습니다. 먼저 가장 안정된 Si와 O주위의 배위수를 구해보면 4와 2 입니다. Si 주위에 배위수 4를 만족시키기 위해 꼭지점에 O가 위치하면 꼭지점을 공유하면서 충전하므로 SiO2가 사면체가 됩니다. 이 O를 충전하는 방식에 따라 여러가지 결정구조가 만들어지는데 사면체를 충전할때 사면체 사이에 공유하는 꼭지점수로 분류합니다. 그 분류는 아래 표와 같습니다. 공유 꼭지점 수가 최대로 4이면 3차원으로 계속 충전하고 앞서말한 크리스토발라이트 구조가 됩니다. 즉 사면체에 꼭지 산소 원자마다 다시 Si가 붙어 진행합니다. 위 오른쪽 그림과 같이 사면체 두개가 하나의 산소(꼭지점)를 공유하고 있습니다. 즉 산소가 두개의 사면체를 공유합니다.. 다시말해 모든 산소가 두개 사면체를 고유하는 것입니다. 반면 공유하는 꼭지점의 갯수가 0이면 떨어져있는 사면체가 되며 사면체에 다음원자가 결합하지 않습니다. 즉 위 그림의 왼쪽그림 사면체 상태가 홀로 존재합니다. 으로 O주위에 Si가 하나만 있으면 전기중성도를 만족하지 못해 꼭지점 수가 3개 이하인 규산염에는 다른 양이온이 첨가됩니다. 이외에 파이로규산염(pyrosilicate)으로 O/Si=3.5도 있으며, 메타규산염(metasilicate)로 O/Si=3인 것이 있다. 특히 이 메타규산염의 경우 위 그림과 같이 공유꼭지점의 수의 수치는 같으나, 서로 다른 모양을 형성할 수 있다. 위 그림은 공유꼭지점수가 5/2인 이중사슬규산염(double chain silicate)으로 O/Si의 비가 2.75이고 두 줄의 사슬로 구성될 수 있고 사면체가 2개 또는 3개의 꼭지점을 공유할 수도 있습니다. 공유 꼭지점수가 3개가 된다면 위 그림과 같이 O/Si의 비가 2.5인 판 규산염(sheet silicate)이 도출됩니다. 반응형
KorEArtH NET
4-1. 원자의 전자구조 – 주기율표
4-2. 이온 반경과 배위수
4-3. 화학 결합의 종류와 그에 따른 물리적 성질
4-4. 전기음성도와 이온결합성
4-5. 정출 순서와 풍화에 대한 저항도
참고문헌
4-2. 이온 반경과 배위수
[그림 4-2-1] 베르너 하이젠버그 (1901-1976)원자의 질량은 핵에 의해 결정되고, 크기는 전자에 의해 결정됨은 앞에서 설명한 바 있다. 그렇다면, 여기서 말하는 원자의 크기란 도대체 무엇일까? 그 것은 마치 당구공과 같이 전자가 핵 주위의 제한된 영역을 차지함으로써 원자가 일정한 공간을 항상 차지한다는 의미일까? 물론 그렇지 않다. 양자론의 기틀을 세우는데 매우 중요한 역할을 한 과학자중의 하나인 하이젠버그(Werner Heisenberg; 1901-1976)는 전자와 같이 작은 입자의 속도와 위치를 동시에 정확히 측정할 수 없다는 “불확정성의 원리(uncertainty principle)”를 수학적으로 증명하였다. 이 원리는 원자의 기술이 더 이상 보어(Bohr) 모델과 같은 뉴톤 물리를 사용할 수 없음을 의미하였으며, 그 대신 확률론에 근거한 양자론과 같은 전혀 새로운 체계의 수학적 기법의 도입이 필요함을 지시하였다. 이 불확정성의 원리에 따르면 전자가 정확히 어떠한 위치에 존재하는지 정할 수 없으며, 따라서 원자(또는 이온)의 크기 또한 정확히 측정할 수 없다. 그러므로, 원자의 실제크기 또는 이온의 실제 반경 같은 것은 없다고 보는 것이 타당할 것이다.
[그림 4-2-2] 라이너스 폴링 (1901-1994)그렇다면 여기서 얘기하는 원자의 크기 또는 이온 반경이란 무엇인가? 이 것은 분자 또는 결정을 구성하는 원자 또는 이온 핵 간의 거리를 바탕으로 계산된 가상의 크기인 것이다. 예를 들면, 염소 분자 Cl 2 의 염소 핵 간 거리를 측정한 후 이를 2로 나누고, 이를 염소의 반경으로 한다. 다음, 소금 결정 NaCl의 Na 핵 및 Cl 핵 간 거리를 측정한 후 이 거리에서 앞에서 계산된 염소의 반경을 빼고 난 값을 Na 이온의 반경으로 하는 식이다. 이와 같은 측정과 체계적인 자료정리는 최초 폴링(Linus Pauling; 1901-1994)에 의해서 시도되었는데, 이는 그가 결정 내 원자간 결합과 결정의 물리화학적 성질을 그의 VB (valence bond theory)로 보다 쉽게 설명하기 위해서였다. 비록, 이렇게 정해진 원자 또는 이온 반경들이 가상의 값이기는 하지만, 여러 결정 및 분자에서 마치 이들 원자와 이온들이 공 모양의 실제 크기를 갖는 것처럼 거의 일정한 값을 갖는 것이 알려졌고, 이를 이용해 분자 또는 결정의 구성 원소간 기하학적 분포와 치환에 대해 예측할 수 있음이 발견되었다. 이러한 이유로, 폴링 이후 많은 결정화학자들이 원자 및 이온의 반경을 보다 정확히 측정하려 노력하였으며, 이 과정에서 이들의 값이 결합 환경에 따라 조금씩 다름이 보다 명확하게 알려졌다. 현재 가장 많이 사용하는 원자 및 이온 반경의 값은 쉐논(R.D. Shannon)이 1976년 Acta Crystallographica에 발표한 “원소들의 유효 이온 반경” 값들이다. 이 이온 반경들은 이온의 결합 환경에 따라 자세히 세분해서 기록되어 있다. Shannon의 이온 반경의 일부를 보려면 [여기]를 눌러보자.
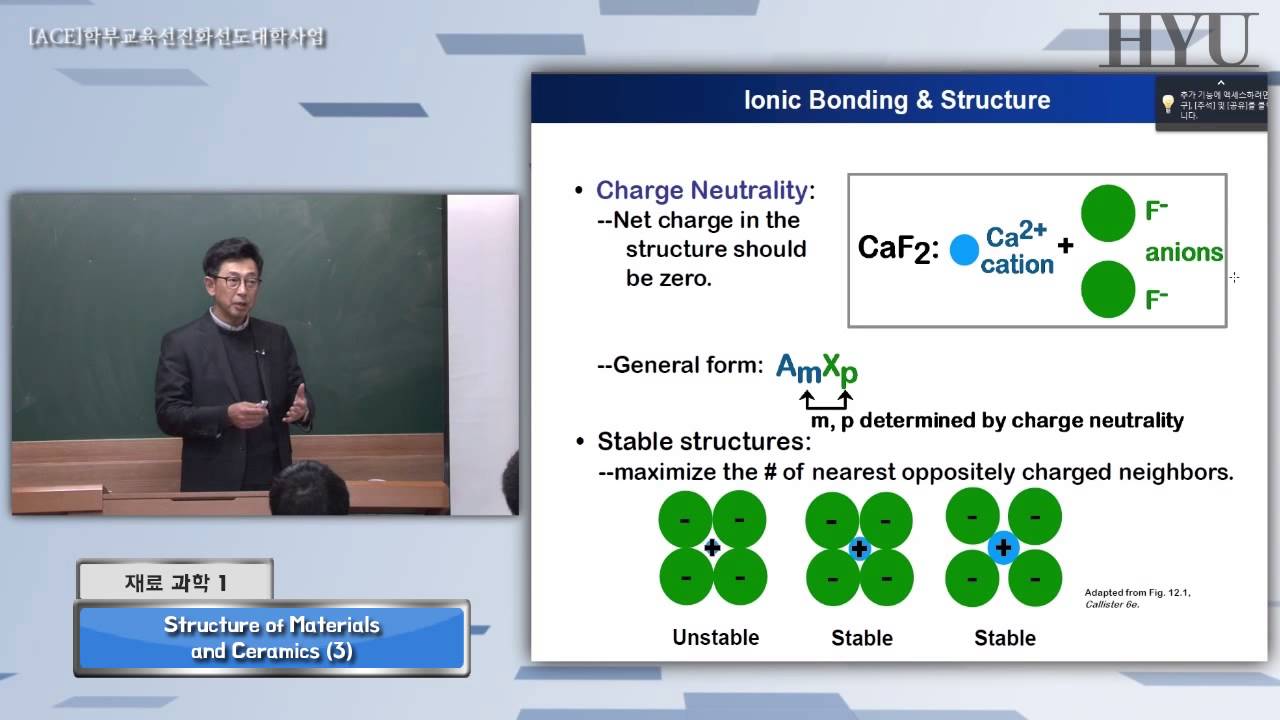
우리는 흔히 양이온과 음이온이 결합하여 결정을 만든다고 생각한다. 이러한 생각은 완전히 맞는 것도 그렇다고 완전히 틀린 것도 아니다. 이에 대해서는 뒤에 좀 더 자세히 얘기하기로 하고 일단은 그와 같이 이온과 이온의 결합으로 결정 또는 고상이 만들어진다고 생각하자. 이 때 하나의 이온은 다른 종류의 이온들에 의해 둘러 쌓이는데, 이를 배위(coordination) 라 하고, 둘러 싸고 있는 이온들의 수를 배위수(coordination number) 라 한다. 배위수는 둘러 싸인 이온과 둘러 싼 이온 간의 크기 비율, 즉 이온반경비(ionic raius ratio 또는 간단히 radius ratio) 에 의해 정해진다.
[그림 4-2-3] 팔면체의 경우 양이온 음이온 배위예를 들어 보자. 만일, 양이온과 음이온이 결합하여 정팔면체 모양의 배위를 한다고 가정하자. 이 경우 정팔면체의 가운데를 수평으로 자르면 옆 그림 4-2-3과 같은 정사각형 모양의 단면을 얻을 것이다. 만일, 모든 구성 이온들이 정확하게 맞 물려서 서로 간에 조금의 빈틈도 없다면, 이 정사각형 변의 길이 ㅣ과 대각선 길이 d는 각각
l = 2r – ,
d = 2r – + 2r + (4-1)
과 같이 될 것이다. 여기서 r – 와 r + 는 각각 음이온과 양이온의 이온 반경이다. 정사각형의 한 변과 대각선의 길이는 또한 다음과 같은 관계를 갖는다:
d = √2 l (4-2)
위 (4-1) 식과 (4-2) 식을 연립하면 다음과 같은 이온 반경비를 얻을 수 있다.
r + /r – = 0.414 (4-3)
즉, 양이온이 음이온의 41.4% 정도의 크기를 가지면 양이온을 중심으로 여섯 개의 음이온이 둘러 싸 (배위수=6) 팔면체 형태의 기하학적 모양을 이룰 수 있다는 말이다. 이 때 주의할 것은 위에 계산된 양이온의 크기가 팔면체를 이루기 위한 최소 크기라는 것이다. 이 보다 양이온이 크면 음이온 간의 거리가 좀 더 멀어지면 되므로 싱관 없지만 만일 더 적으면 음이온 간의 전자 구름이 겹치면서 대단히 강력한 반발에너지를 내기 때문에 결정 구조가 불안정하게 되기 때문이다.
아래 표는 위와 같은 방식으로 계산된 이온반경비와 배위수, 그리고 이로 인한 배위의 기하학적 모양을 정리한 것이다. 이 이온 반경비와 그로 인한 배위수는 전하와 함께 구성 성분간의 치환 여부를 결정하는 가장 중요한 요소이다.
[표 4-2-1] 이온 반경비에 따른 배위수 및 그 배위의 기하학적 모양이온반경비 배위수 기하학적 모양 <0.155 2 직선 0.155-0.225 3 삼각형 0.225-0.414 4 사면체 0.414-0.732 4 사각형 0.414-0.732 6 팔면체 0.732-1.00 8 육면체 >1.00 12 육면체(edge-centered)
4-3. 화학 결합의 종류와 그에 따른 물리적 성질에 계속
이온결합에너지 Ionization energy : 원자가 양이온이 되는데 필요한 에너지. electron
이온결합에너지
Ionization energy : 원자가 양이온이 되는데 필요한 에너지.
electron affinity : 원자가 전자를 추가하여 음이온이 되는데 필요한 binding energy. Interaction energy between the ions
0 : permittivity of free space Bij: empirical constant Rij: interatomic separation n : ∼ 10 N개의 원자들로 구성된 결정에 대하여는
MX의 화학식에 대해서
양이온의 하전 = Zc 음이온의 하전 = Za 이온간 거리 Rij ijRx 0 , (RoRARc)
Madelung Constant “The energy of a particular crystal structure relative to the same number of isolated molecules”
Madelung 상수는 정전기적 안정도(electrostatic stabilization)의 척도로서 안정한 결정은 1 보다 큰 값을 가진다. Zinc Blende와 Wurtzite는 Madelung 상수값이 거의 비슷한데 이와 같은 경우에는 동질다상(polymorphism)을 형성한다.
Pauling’s Rule
이온결합성이 강한 구조에서 서로 다른 이온간의 인력은 최대로 하고 같은
r
r 의 값에 따라서 CN이 결정된다. 즉, CN=4이면 tetrahedral site에
들어가고 CN=6이면 octahedral site에 들어간다.
ex) AX 양이온 : 음이온 = 1: 만일 CN=6이면 X가 형성하는 모든 octahedral site에 들어간다. (∵octahedral site : X = 1:1) 만일 CN=4이면 X가 형성하는 tetrahedral site의 1/2를 채운다. (∵tetrahedral site : X = 2:1) 이와 같이 부분적으로 interstitial site를 채울 때에는 양이온간의 거리가 최대가 되도록 채운다. (cf. Pauling’s rule 3 & 4)
anion- packing
filled interstitial
FCC
all octahedral ⇒ NaCl 구조 all tetrahedral ⇒ Antifluorine 구조 half tetrahedral ⇒ Zine Blende 구조 → Diamond 구조 (Zine Blende Derived structure)
HCP
2/3 octahedral ⇒ Corundum구조( AlO 32 ) → Derived structure :LiNbO 3 , FeTiO 3 half octahedral ⇒ Rutile 구조 half tetrahedral ⇒ Wurtzite 구조
Ionic crystal의 원자 반경 ① 원자번호가 증가할수록 반경 증가. Li Na K Rb Cs
원자번호 3 11 19 37 55
r 0. 0
0.
5
1.
3
1.
8
1.
9
② 같은 수의 최외각 전자를 가지는 양이온들의 경우, 하전이 증가할수록
이온반경 감소.
Li Mg 2 Al 3 r 0. 5
0 0.
③ 같은 수의 최외각 전자를 가지는 음이온들의 경우, 하전이 증가할수록
음이온의 이온반경 증가.
F O 2 Cl S 2 원자번호 9 8 17 16 r 1. 6
1.
1.
1
1.
4
④ Lanthanide (rare-earth, 희토류원소)의 경우, 원자번호가 증가할수록> 이온반경 감소. lanthanide의 모든 원소들은 최외각에 같은 원자 배열을 가지고 z의 차이에 따른 전자들은 깊숙이 묻혀서 증가된 원자핵 하전수에 의한 인력의 증 가로 이온반경이 감소한다. ⑤ 대부분 양이온의 이온반경 < 1Å 대부분 음이온의 이온반경 > 1Å ∴ 이온 결합 물질에서 음이온이 차지하는 부피가 같다.
Morphotropy : 체계적인 화학적 치환에 따른 결정구조의 점진적 변화 · 이온반경의 영향 · 양이온과 음이온 사이의 거리 (A-X 거리) 만일 Cs대신에 Cs보다 이온 반경이 작은 양이온으로 치환하면 A-X 거리가 감소. ⇒ potential energy 감소. ∴안정된 구조. 점점 양이온의 크기가 감소하여 음이온들끼리 접촉하는 범위까지는 안정화된 구조를 가지나, 이보다 더 크기가 작은 양이온으로 치환되면 양이온이 “rattle”하여 구조가 불안정해진다.
4 r 3 2
Rr 3 2 2 .0 225
3) 6배위
사각형 한변을 a라 하면 a=2R (2Rr)a 2 (2Rr) 2 R 2 rR 2( )
2 1 . 414 R
r
4) 8배위
한변을 a라하면, 대각선의 길이는a 2 , 여기서 a 2 R 선분 AB의 길이는 a 3 a 3 2 R 3 2 R 3 (2rR) r 3 R R 3 1 .0 732 R
r
여러 가지 구조에서 안정된 배위을 갖기 위한
r
r 의 범위
Atomic Packing
다음 그림은 2 개의 원자층을 보여주고 있다. 실선으로 그린 원자층은 아래에
있는 층이고 점선으로 표시된 층은 바로 위에 있는 층이다.
원자들이 최밀충진(close-packing)을 할 때, 3번째 층을 쌓을 때 2 가지 방법이 있다. 2 번째 층위에 원자들이 안정된 위치에 자리할 수 있는 방법은, 원래 맨 아래에 있는 첫번째 층 바로 위에 원자를 놓는 방법과 첫번째 층과 다른 위치에 놓는 방법이 있다. 만일 원자들이 첫번째 층과 같은 위치에 놓인다고 하면 각 층을 A, B, C등으로 표시했을 때, A-B-A-B-A…등이 될 것이다. 이 경우에는 아래의 그림과 같이 hexagonal close-packed(HCP) array를 형성한다.
만일 3 번째 원자층이 첫번째 원자층과 다른 위치에 놓인다면 원자면의
적층순서는 A-B-C-A-B-C-A…등이 될 것이고 cubic close-packed(CCP 혹은
Interstice 2개의 원자층사이에는 빈 틈새가 존재하는데 이를 interstice라고 부르고 4 배위자리(tetrahedral site)와 6 배위자리(octahedral site)의 2
가지가 존재한다. 이러한 interstice에 작은 크기의 양이온이 들어가 여러 가지 세라믹 구조를 형성한다.
또 다음 그림은 FCC와 HCP구조에서 tetrahedral site와 octahedral site를 보여준다. FCC구조에서 각 모서리의 중심에 octahedral site가 1/4씩
존재하고 체심(body center)위치에 1 개 존재하여 총 12 1 4 4
1 개의
octahedral site가 존재한다. 또한 tetrahedral site는 c-축방향으로 1/4, 3/ 의 위치에 각각 4 개씩 존재하여 총 8 개의 tetrahedral site가 존재한다.
아래 그림은 HCP 단위포(unit cell)인데, 검은색으로 그려진 원자만이 단위포에 속하고 파란색으로 그려진 원자는 octahedral site가 6 배위임을 보여주기
은 계통적으로 한 개의 중심점을 기준으로 해서 32 개의 점배열 방식이 있을 수
있다. 그리고 이것들을 나타내는 그림이 바로 14 개의 브라바이스 격자
(Bravaislattice) 혹은 공간격자(Space lattice)라 불리는 격자이다.
Fourteen Bravais or space Lattices
이것들의 공간 격자에서 얻어지는 관용 단위포는 아래에 나타내었다. 아래 그림과 같이 관용 단위포는 단위포의 축과 이것들이 이르는 각도로서 나타낸다. 이것들의 격자는 대칭성이 높게 되는 순서로서- 3사(triclinic), 단사 (monoclinic), 사방(orthorombic), 정방(tetragonal), 육방(hexagonal) 및, 입방(cubic)의 6 종류의 결정계로 분류된다. 격자의 방향이나 면등, 격자의 기하학적 특징은 단위포의 축 길이를 기준으로 하면 대단히 편리하게 기술된다.
Ch.4. 결정화학 이온(원자) 반경과 배위수(Coordination Number: CN) 이온반경: CN
We think you have liked this presentation. If you wish to download it, please recommend it to your friends in any social system. Share buttons are a little bit lower. Thank you!
Buttons:
세라믹스 [ceramics]의 이해와 특성
이온의 크기가 음이온과 같거나, 보다 클 대에는 12배위가 된다. 그러나 다른 요인으로 이 범위를 벗어나는 일이 발생하기도 하나, 일반적으로 이온반경비로부터 예상되는 배위가 실제적이나, 기하학적으로 허용되는 하한의 이온반경에 가까울수록 안정한 물질이라고 할 수 있다. 배위수와 물성과는 밀
47페이지 | 2,200원 | 2010.01.17
이온 반지름 비를 통한 결정 구조 예측
728×90
이온 반지름 비를 통한 결정 구조 예측
[문제]LiBr 결정에서 이온들은 각각 면심입방 단위세포로 배열되어 있다. Li와 Br의 비율이 1 : 1인 어떤 LiBr 시료의 단위세포 한 모서리의 길이가 5.5 Å이며, 밀도는 3.18 g/cm3이다. LiBr의 화학식량은 87이며, 단위세포의 부피는 166Å3이다.
1. Li+의 배위수는?
2. Li+의 반지름이 0.9 Å일 때, 이온 반지름 비를 이용해서 예측한 구조와 실제 구조가 일치하는가?
3. 시료에 빈자리 결함(Schottky defect)을 가지고 있다고 판단할 수 있는가?
[출처] 2009학년도 중등교사신규임용 후보자 선정 경쟁 시험 13번0. 들어가기
2009학년도 중등임용 문제이다. 2009년부터 2013년까지는 전공 1차 시험이 객관식 40 문항으로 진행되었었다. 고체 단원 문제로 이온 결정의 배위수, 결정 구조, 결함 등을 묻는 것으로 미루어보아 무기화학 분야로 출제되었을 가능성이 크다. 그러나 경우에 따라서는 일반화학 수준에서도 충분히 접근해볼 만하다. (3번의 고체 결함(defect)에 관한 내용 포함 유무는 일반화학 책마다 차이가 있을듯 하다.)
1. 이온 결정의 배위수
가장 대표적인 이온 결합 물질로 염화나트륨(NaCl)이 있다. 염화나트륨의 구조를 면심입방구조(face centered cubic, fcc)라 말하는 것은, 다소 명확함이 떨어지는 표현이다. (염화세슘(CsCl)의 구조를 체심입방구조로 부르는 것도 비슷하다. 엄밀히 말해서 염화세슘은 Cs+와 Cl-가 모두 단순입방구조를 가지며, 엇갈린 배열에 의해 단위세포만 떼어 보았을 때, 마치 체심 입방 구조와 비슷해 보일 뿐이다. 이를 체심입방구조라 표현하는 것은 어딘가 잘못되었다.) [관련 글] : 128. 고체의 결정 구조
단순입방구조, 면심입방구조, 체심입방구조 등은 브라베(Bravais) 결정 분류 중 한 가지로, 한 종류의 입자만으로 구성된 단위 세포 분류에 사용되는 용어다.
따라서 NaCl과 같이 두 종류 이상의 입자로 구성된 결정의 구조를 칭할 때는 NaCl 형 구조와 같이 대표 물질을 통해 구조를 나타내거나 양이온과 음이온이 모두 면심입방(fcc) 배열인 결정 구조라 말하는 것이 보다 바람직하다.
그림 1. Na+양이온과 Cl-음이온이 모두 면심입방구조(fcc)로 배열되어 있다.
문제의 LiBr의 경우 양이온과 음이온이 모두 면심입방구조로 배열되어있다고 했으므로, 위의 그림과 같은 NaCl형 구조를 갖는다.
즉, 첫 번째 문항은 NaCl 형 구조에서 양이온(Li+, ●)의 배위수를 묻는 것과 같다.
배위수란? 한 입자 주위에 가장 인접하여 위치한 입자의 수를 말한다. 동일 입자만으로 구성된 결정 구조와는 달리 이온 결정에서의 배위수는 양이온(Li+)을 둘러싼 가장 근접한 음이온(Br-)의 수, 또는 음이온(Br-)을 둘러싼 가장 근접한 양이온(Li+)의 수를 말한다. 따라서 대상이 되는 중심 입자의 종류를 명확하게 표현해주어야 한다.
위의 [그림 1]을 통해 NaCl형 구조의 양이온(Li+, ●)에 가장 인접한 음이온(Br-, ●)의 수는 6 개임을 알 수 있다.
2. 이온 반지름 비(r+/R-)에 따른 결정 구조
양이온(r+)과 음이온(R-)의 반지름 비(r+/R-)에 따라 이온 결정의 구조가 달라진다. 이온 결정 형성 과정은 반지름이 큰 음이온이 먼저 배열되고, 그로 인해 만들어진 틈새 자리에 크기가 작은 양이온이 채워져서 만들어진다고 설명한다. 예를들어 음이온이 면심입방구조로 배열되었을 때, 팔면체 틈새자리(Oh hole)와 사면체 틈새자리(Td hole)가 생긴다.
이때, 양이온의 크기(반지름)에 따라 팔면체 틈새자리(r/R = 0.414 ~ 0.732)를 채울 수도 있고, 사면체 틈새자리(r/R = 0.225 ~ 0.414)를 채울 수도 있다.
[출처] Miessler Inorganic Chemistry 5th, Table 7-1NaCl형 구조는 음이온(R)이 만든 팔면체 틈새자리에 양이온(r)이 채워져서 만들어진 결정 구조이다. NaCl형 구조의 단위 세포 한 변 길이(a)와 이온 반지름 r, R 사이에는 다음과 같은 관계가 있다.
음이온(R)이 만든 팔면체 틈새 자리에 양이온(r)이 채워진 모습
1) 단위세포 한 변의 길이 : a = 2R + 2r
2) 단위세포 대각선의 길이 : √2 a = 4R
———————————————–
1)식을 2)식에 대입 : 2√2 R + 2√2r = 4R , r/R = √2 – 1 ≒ 0.414
즉, 양이온 반지름(r+)이 음이온 반지름(R-)의 0.414 배일 때, 팔면체 틈새자리에 딱 들어맞는다. 양이온 반지름 크기가 이보다 작으면, 사면체 틈새자리를 선호하며, 양이온 반지름이 0.732 배를 넘으면, 육면체 틈새자리를 선호한다.
[참고] 틈새 자리의 종류와 크기를 구하는 과정은 다음 링크에 잘 정리되어 있다. : onsaem9134.tistory.com/32이제 문제로 돌아와보자.
문제에 제시된 LiBr은 NaCl형 구조이다. 양이온의 반지름이 r+ = 0.9 Å일 때, 양이온과 음이온의 반지름 비(r/R)로 예측한 구조 역시 NaCl형이 되는지를 묻고 있다. 예상치와 실제 구조가 일치하려면 반지름 비(r/R)가 0.414 ~ 0.732 사이 값이 나와야 한다.
단위세포 한 변의 길이 a = 5.5 Å, 양이온(Li+)의 반지름 r- = 0.9 , NaCl형 구조에서 음이온(Br-)의 반지름(R-)을 구해보자.
a = 2R + 2r , 5.5 Å = 2R + 2(0.9) , R = 1.85 Å
양이온과 음이온의 반지름을 모두 알았으니 반지름 비(r/R)를 구해보자.
r/R = 0.9 / 1.85 ≒ 0.483 ( 0.414 < r/R < 0.732) 반지름 비는 약 0.483으로 0.414 ~ 0.732 사이의 값을 갖는다. 반지름 비로 예측한 구조 역시 NaCl형에 부합하며, 실제 구조와 일치함을 알 수 있다. * 만약, 문제에서 양이온의 크기를 0.7 Å로 주었다면, R = 2.05가 되고, r/R = 0.341이 된다. 반지름 비가 0.225 ~ 0.414 사이의 값을 갖기 때문에, 이 때 예측한 구조는 ZnS이 될 것이며, 실제 구조인 NaCl형과 다르다는 결과에 도달할 것이다. 3. 밀도를 통한 빈자리 결함(Schottky) 예측 밀도 [g/cm3]는 단위 부피 [cm3] 당 존재하는 물질의 질량 [g]이다. LiBr 단위 세포 하나의 부피는 155 Å3이라고 문제에서 주어졌으므로, 부피를 [cm3] 단위로 변환하고, 단위 세포 내 존재하는 LiBr의 질량 [g]만 알면, 예상되는 밀도 값 [g/cm3]을 알 수 있다. 문제에서 실제 밀도 3.18 [g/cm3]값이 라고 제시되었는데, 이 값이 예상되는 밀도값과 비슷하면, 결함을 예상하기 어렵지만, 예상되는 밀도(이론값)보다 실제 밀도(실제값)가 작다면, 일부 이온이 자리를 이탈한 빈자리 결함(Schottky defect)이 있을 것이라고 기대할 수 있다. [출처] Oxtoby Principles of Modern Chemistry 7th Fig 21.27.(b) 이론적으로 예상되는 밀도 [g/cm3]를 구해보자. 단위 세포에는 총 4 개의 LiBr이 존재한다. LiBr의 화학식량이 87이므로, LiBr 1 [몰]의 질량이 87 [g]이라는 뜻이다. 1 [몰]은 6.02 x 1023 [개] 이다. LiBr 1 [몰] = 87 [g] , 1 [몰] = 6.02 x 1023 [개] 우리가 원하는 것은 LiBr 4 개의 질량 [g]이다. 단위 세포 당 포함된 LiBr 4 개의 질량을 구했다. 이제 단위 세포 부피만 [cm3] 단위로 변환해주면 된다. 1 [Å] = 10-10 [m] , 1 [cm] = 10-2 [m] , 1 [cm3] = 1 [(10-2)3 m3] = 10-6 [m3] 질량과 부피를 모두 알았으니 LiBr의 밀도 [g/cm3]를 나타내어 보자. LiBr의 이론적 밀도 = 3.73 g/cm3 실제 밀도(=3.18 [g/cm^3])가 이론적인 밀도값(=3.74 [g/cm^3])보다 작다는 것을 통해 결정에 빈자리 결함이 있을 것으로 예상할 수 있겠다. * 내용 중 오타나 오류가 있는 경우 댓글로 알려주시면, 최대한 빠른 시일 내에 수정/답변드리도록 하겠습니다. 감사합니다. 728x90 반응형
키워드에 대한 정보 이온 반 경비
다음은 Bing에서 이온 반 경비 주제에 대한 검색 결과입니다. 필요한 경우 더 읽을 수 있습니다.
이 기사는 인터넷의 다양한 출처에서 편집되었습니다. 이 기사가 유용했기를 바랍니다. 이 기사가 유용하다고 생각되면 공유하십시오. 매우 감사합니다!
사람들이 주제에 대해 자주 검색하는 키워드 20150326 재료과학1
- 동영상
- 공유
- 카메라폰
- 동영상폰
- 무료
- 올리기
20150326 #재료과학1
YouTube에서 이온 반 경비 주제의 다른 동영상 보기
주제에 대한 기사를 시청해 주셔서 감사합니다 20150326 재료과학1 | 이온 반 경비, 이 기사가 유용하다고 생각되면 공유하십시오, 매우 감사합니다.
